Буфер решења су течности на бази воде које укључују и слабу киселину и њену коњугирану базу. Због своје хемије, пуферски раствори могу одржавати пХ (киселост) на готово константном нивоу чак и када се дешавају хемијске промене. Системи пуфера се јављају у природи, али су такође изузетно корисни у хемији.
Користи се за пуфер решења
У органским системима, природни пуферски раствори одржавају пХ на конзистентном нивоу, омогућујући да се одвијају биохемијске реакције, а да не наштете организму. Када биолози проучавају биолошке процесе, они морају одржавати исти константни пХ; да би то учинили користили су припремљене пуферске растворе. Пуферни раствори први пут су описани 1966. године; данас се користе многи од истих пуфера.
Да би били корисни, биолошки пуфери морају да испуњавају неколико критеријума. Точније, они треба да буду растворљиви у води, али нису растворљиви у органским растварачима. Оне не би могле да пролазе кроз ћелијске мембране. Поред тога, морају бити нетоксични, инертни и стабилни у свим експериментима за које се користе.
Пуферни раствори природно се јављају у крвној плазми, због чега крв одржава стални пХ између 7,35 и 7,45. Буфер раствори се такође користе у:
- процеси ферментације
- умируће тканине
- хемијска анализа
- калибрација пХ метара
- ДНК екстракција
Шта је Трис пуфер решење?
Трис је кратак за трис (хидроксиметил) аминометан, хемијско једињење које се често користи у физиолошком раствору јер је изотонично и нетоксично. Будући да Трис има пКа од 8,1 и ниво пХ између 7 и 9, раствори Трис пуфера се такође често користе у низу хемијских анализа и поступака, укључујући екстракцију ДНК. Важно је знати да се пХ у раствору трис пуфера мења са температуром раствора.
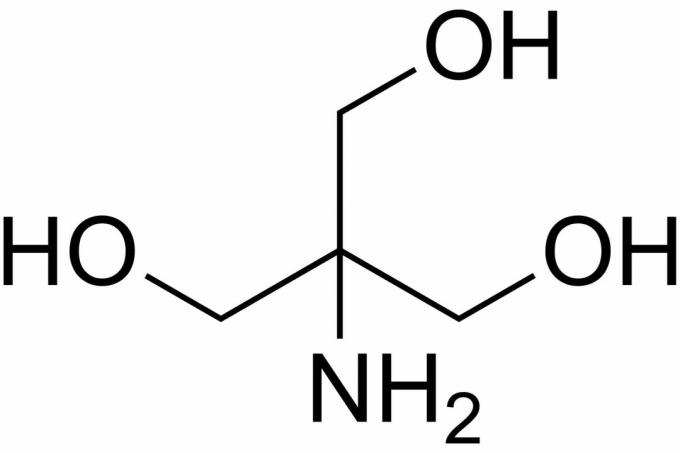
Како припремити Трис пуфер
Лако је пронаћи комерцијално доступно решење трис пуфера, али могуће је и сами направити одговарајућу опрему.
Материјали:
Израчунајте количину сваке ставке која вам је потребна на основу моларне концентрације раствора коју желите и количине пуфера који вам је потребан.
- трис (хидроксиметил) аминометан
- дестилована дејонизована вода
- ХЦл
Процедура:
- Започните одређивањем концентрације (моларитет) и волумен Трис међуспремника који желите да направите. На пример, раствор Трис пуфера који се користи за слани раствор варира од 10 до 100 мМ. Након што одлучите шта правите, израчунајте број молова Триса који су потребни тако да помножите моларну концентрацију пуфера са волуменом пуфера који се прави. (молови Трис = мол / Л к Л)
- Затим одредите колико је грама Трис-а множењем броја молова у молекуларној маси Трис-а (121,14 г / мол). грама Трис = (мола) к (121,14 г / мол)
- Растворите Трис у дестиловану дејонизовану воду, 1/3 до 1/2 ваше жељене коначне запремине.
- Помешати у ХЦл (нпр., 1М ХЦл) до пХ метар даје вам жељени пХ за раствор Трис пуфера.
- Разблажите пуфер водом да бисте постигли жељени крајњи волумен раствора.
Једном када се раствор припреми, може се чувати месецима на стерилном месту на собној температури. Дуг рок трајања раствор Трис пуфера је могућ јер раствор не садржи никакве протеине.