Атомска и молекуларна структура
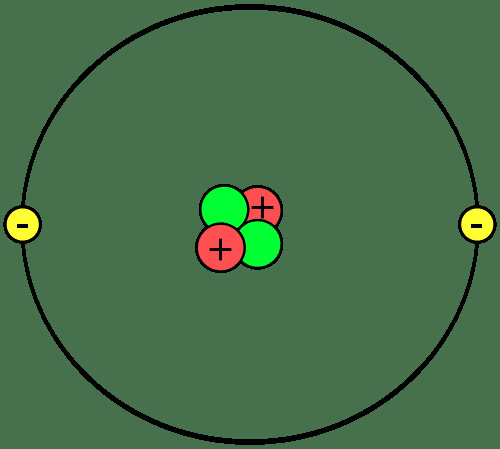
Градевине материје су атоми, који се удружују у формирање молекула или једињења. Важно је знати делове атома, шта су јони и изотопи и како се атоми спајају.
Делови Атома
Атоми се састоје од три компоненте:
- протони - позитивно електрично наелектрисање
- неутрони - без електричног набоја
- електрони - негативни електрични набој
Протони и неутрони формирају језгро или центар сваког атома. Електрони круже око језгра. Дакле, језгро сваког атома има нето позитиван набој, док спољни део атома има нето негативан набој. У хемијским реакцијама, атоми губе, добијају или деле електроне. Језгро не учествује у обичним хемијским реакцијама, иако нуклеарно пропадање и нуклеарне реакције могу проузроковати промене у атомском језгру.
Атоми, јони и изотопи
Број протона у атому одређује који је елемент. Сваки елемент има једно или дво слово симбол која се користи да се идентификује у хемијским формулама и реакцијама. Симбол хелијума је Хе. Атом са два протона је атом хелија, без обзира колико неутрона или електрона има. Атом може имати исти број протона, неутрона и електрона или се број неутрона и / или електрона може разликовати од броја протона.
Атоми који носе нето позитивно или негативно електрично наелектрисање су јони. На пример, ако атом хелија изгуби два електрона, он би имао набој +2, што би било написано Хе2+.
Варирајући број неутрона у атому одређује који изотоп елемента је. Атоми се могу записати нуклеарним симболима да идентификују њихов изотоп, где је број нуклеона (протона плус неутрона) је приказан горе и лево од симбола елемента, са бројем протона који су наведени доле и лево од симбол. На пример, три изотопа водоника су:
11Х, 21Х, 31Х
Како знате да се број протона никада не мења за атом елемента, изотопи се чешће пишу користећи симбол елемента и број нуклеона. На пример, могли бисте да напишете Х-1, Х-2 и Х-3 за три изотопа водоника или У-236 и У-238 за два уобичајена изотопа урана.
Атомски број и атомска тежина
Тхе атомски број атома идентификује његов елемент и његов број протона. Тхе атомска маса је број протона плус број неутрона у елементу (јер је маса електрона тако мала у поређењу с масом протона и неутрона да се у основи не рачуна). Атомска тежина се понекад назива атомском масом или бројем атомске масе. Атомски број хелијума је 2. Атомска тежина хелијума је 4. Имајте на уму да атомска маса елемента у периодичној табели није цео број. На пример, атомска маса хелијума је дата као 4.003, а не 4. То је зато што периодична табела одражава природно обиље изотопа неког елемента. У хемијским прорачунима користите атомску масу наведену у периодичној табели, под претпоставком да узорак неког елемента одражава природни распон изотопа за тај елемент.
Молекуле
Атоми међусобно дјелују, често формирајући хемијске везе међусобно. Када се два или више атома повезују један са другим, формирају молекул. Молекул може бити једноставан, као што је Х2или сложенијих, као што је Ц6Х12О6. Претплате означавају број сваке врсте атома у молекули. Први пример описује молекул формиран од два атома водоника. Други пример описује молекул формиран од 6 атома угљеника, 12 атома водоника и 6 атома кисеоника. Иако бисте могли да пишете атоме било којим редоследом, конвенција је да прво напишете позитивно наелектрисану прошлост молекула, а затим негативно наелектрисани део молекула. Дакле, натријум-хлорид је написан НаЦл, а не ЦлНа.
Биљешке и преглед периодичне табеле
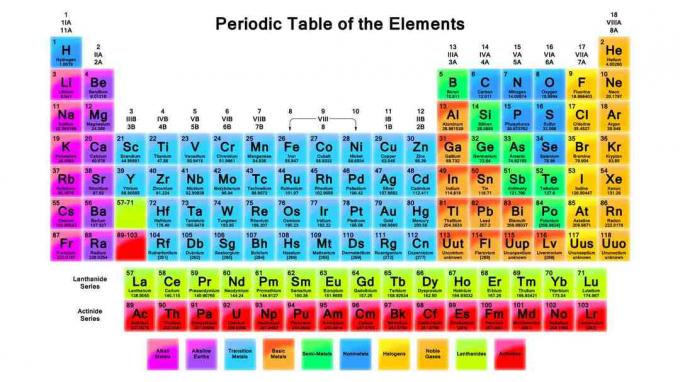
Периодна табела је важно средство у хемији. Ове белешке прегледавају периодичну табелу, како је она организована и трендове периодичних табела.
Проналазак и организација периодичне табеле
1869. год. Дмитри Менделеев организовао је хемијске елементе у периодичну табелу слично ономе коју данас користимо, осим његових елемената наређени су према повећању атомске тежине, док је савремена табела организована повећањем атомске масе број. Начин на који су елементи организовани омогућава уочавање трендова у својствима елемената и предвиђање понашања елемената у хемијским реакцијама.
Позвани су редови (померајући се лево десно) периоде. Елементи у неком периоду имају исти највиши енергетски ниво за неискоришћени електрон. Како се величина атома повећава, постоји више потпоница по нивоу енергије, тако да постоји више елемената у периодима који се налазе даље испод табеле.
Ступци (крећу се од врха ка дну) чине основу елемента групе. Елементи у групама деле исти број валентних електрона или спољашњи распоред електронских љуски, што елементима у групи даје неколико заједничких својстава. Примери група елемената су алкални метали и племенити гасови.
Трендови или периодичност табеле периодичне табеле
Организација периодичне табеле омогућава увид у трендове својстава елемената. Важни трендови односе се на атомски радијус, енергију јонизације, електронегативност и афинитет електрона.
-
Атомски радијус
Атомски полумјер одражава величину атома. Атомски радијус смањује прелазак с лева на десно током периода и повећава се кретање од врха до дна надоле групу елемената. Иако бисте могли помислити да ће атоми једноставно постати већи како добију више електрона, електрони остају у љусци, док све већи број протона вуче љуске ближе језгру. Крећући се низ групу, електрони се налазе даље од језгра у новим енергетским овојницама, па се укупна величина атома повећава. -
Енергија јонизације
Енергија јонизације је количина енергије која је потребна за уклањање електрона из јона или атома у стању гаса. Енергија јонизације повећава се померање с лева на десно током периода и смањује помицање од врха ка дну низ групу. -
Електронегативност
Електронегативност је мјера колико лако атом формира хемијску везу. Што је већа електронегативност, већа је и привлачност за везивање електрона. Електронегативност смањује помицање низ групу елемената. Елементи са леве стране периодичне табеле имају тенденцију да буду електропозитивни или вјероватније донирају електрон него што га прихватају. -
Аффинити електрона
Афинитет електрона одражава колико ће атом прихватити електрон. Афинитет електрона варира у зависности од групе елемената. Племенити гасови имају афинитет електрона близу нуле јер су напунили љуске електрона. Халогени имају високи афинитет електрона јер додавање електрона даје атому потпуно испуњену љуску електрона.
Хемијске везе и лепљење

Хемијске везе лако је разумети ако имате на уму следећа својства атома и електрона:
- Атоми траже најстабилнију конфигурацију.
- Правило октета каже да ће атоми са 8 електрона у својој спољној орбити бити најстабилнији.
- Атоми могу да деле, дају или узимају електроне других атома. Ово су облици хемијских веза.
- Везе настају између валентних електрона атома, а не унутрашњих електрона.
Врсте хемијских веза
Две главне врсте хемијских веза су јонске и ковалентне везе, али треба да знате неколико облика везивања:
-
Јонске обвезнице
Јонске везе формирају када један атом узима електрон из другог атома. Пример: НаЦл је формиран јонском везом, где натријум донира свој валентни електрон хлору. Хлор је халоген. Сви халогени имају 7 валентних електрона и треба им још један да добију стабилан октет. Натријум је алкални метал. Сви алкални метали имају 1 валентни електрон који они лако донирају да формирају везу. -
Ковалентне обвезнице
Ковалентне везе формирају се када атоми деле електроне. Заправо, главна разлика је у томе што су електрони у јонским везама ближе повезани с једним атомским језгра или друго, за које електрони у ковалентној вези постоји вероватноћа да орбитирају око једног језгра као и друго. Ако је електрон уско повезан са једним атомом него са другим, а поларна ковалентна веза могу да се формирају. Пример: Ковалентне везе формирају између водоника и кисеоника у води, Х2О. -
Металлиц Бонд
Кад су оба атома метали, настаје метална веза. Разлика метала је у томе што би електрони могли бити било који атом метала, а не само два атома у једињењу. Пример: Металне везе виде се у узорцима чистих елементарних метала, попут злата или алуминијума, или легура, као што су месинг или бронза.
Можда се питате како можете знати да ли је веза јонска или ковалентна. Можете погледати положај елемената на периодичној табели или табели елемената електронегативности да се предвиди врста обвезнице која ће се формирати. Ако су вредности електронегативности врло различите једна од друге, формираће се јонска веза. Обично је катион метал, а анион неметал. Ако су оба елемента метали, очекујте да ће се формирати метална веза. Ако су вредности електронегативности сличне, очекујте да ће се формирати ковалентна веза. Везе између два неметала су ковалентне везе. Поларне ковалентне везе формирају се између елемената који имају међусобне разлике између вредности електронегативности.
Како именовати једињења - Номенклатура хемије
Да би хемичари и други научници могли међусобно комуницирати, Међународна унија за чисту и примењену хемију или ИУПАЦ договорила је систем номенклатуре или именовања. Чућете хемикалије које се називају њиховим уобичајеним именима (нпр. Со, шећер и сода бикарбона), али у лабораторији бисте користили систематска имена (нпр. Натријум хлорид, сахароза и бикарбонат натријума). Ево прегледа неких кључних тачака о номенклатури.
Именовање бинарних једињења
Једињења се могу састојати од само два елемента (бинарна једињења) или више од два елемента. Одређена правила важе за именовање бинарних једињења:
- Ако је један од елемената метал, прво се именује.
- Неки метали могу да формирају више од једног позитивног јона. Уобичајено је навођење набоја на ион помоћу римских бројева. На пример, ФеЦл2 је гвожђе (ИИ) хлорид.
- Ако је други елемент неметал, име једињења је метално име, а следи словница (скраћеница) имена неметала, а затим "иде". На пример, НаЦл је назван натријум хлорид.
- За једињења која се састоје од два неметала, електропозитивнији елемент прво је назван. Стабло другог елемента је названо, а затим слиједи „иде“. Пример је ХЦл, који је хлороводоник.
Именовање јонских једињења
Поред правила за именовање бинарних једињења, постоје додатне конвенције о именовању за јонска једињења:
- Неки полиатомски аниони садрже кисеоник. Ако елемент формира два оксиоиона, онај са мање кисеоника завршава на -ите, док онај са више оксигена завршава у -ате. На пример:
НЕ2- је нитрит
НЕ3- је нитрат