А моносахарид или једноставан шећер је угљени хидрати то не може бити хидролизован у мање угљене хидрате. Као и сви угљени хидрати, моносахарид се састоји од три хемијска елемента: угљеник, водоник и кисеоник. То је најједноставнији тип молекула угљених хидрата и често служи као основа за формирање сложенијих молекула.
Моносахариди укључују алдозе, кетозе и њихове деривате. Општа хемијска формула за моносахарид је ЦнХ2нОнили (ЦХ2О)н. Примери моносахарида укључују три најчешћа облика: глукоза (декстроза), фруктоза (левулоза) и галактоза.
Кључни поступци: Моносахариди
- Моносахариди су најмањи молекули угљених хидрата. Не могу се разградити на једноставније угљене хидрате, па их се назива и једноставним шећерима.
- Примери моносахарида укључују глукозу, фруктозу, рибозу, ксилозу и манозу.
- Двије главне функције моносахарида у тијелу су складиштење енергије и као саставни дијелови сложенијих шећера који се користе као структурни елементи.
- Моносахариди су кристалне чврсте материје које су растворљиве у води и обично имају слатки укус.
Својства
У чистом облику, моносахариди су кристални, растворљиви у води, безбојни солидс. Моносахариди имају слатки укус јер оријентација ОХ групе делује у интеракцији са рецептором укуса на језику који детектује слаткоћу. Реакцијом дехидрације два моносахарида могу да формирају а дисахарид, три до десет могу формирати олигосахарид, а више од десет могу формирати а полисахарид.
Функције
Моносахариди служе за две главне функције у ћелији. Користе се за складиштење и производњу енергије. Глукоза је посебно важан молекул енергије. Енергија се ослобађа када се прекину њене хемијске везе. Моносахариди се такође користе као градивни блокови за формирање сложенијих шећера, који су важни структурни елементи.
Структура и номенклатура
Хемијска формула (ЦХ2О)н означава да је моносахарид угљени хидрат. Међутим, хемијска формула не показује смештање атома угљеника у молекулу или хиралност шећера. Моносахариди су класификовани на основу колико атома угљеника садрже, смештаја карбонилне групе и њихове стереохемије.
Тхе н у хемијској формули означава број атома угљеника у моносахариду. Сваки једноставан шећер садржи три или више атома угљеника. Они су категорисани према броју угљеника: триоза (3), тетроза (4), пентоза (5), хексоза (6) и хептоза (7). Напомињемо да су све ове класе назване крајњим концем, што указује да су угљени хидрати. Глицералдехид је триозни шећер. Еритроза и треоза су примери тетрозних шећера. Рибоза и ксилоза су примери шећера пентозе. Најчешћи једноставни шећери су хексозни шећери. Они укључују глукозу, фруктозу, манозу и галактозу. Седохептулоза и маннохептулоза су примери моносахарида хептозе.
Алдоза има више од једног хидроксилна група (-ОХ) и карбонилна група (Ц = О) на крајњем угљенику, док кетозе имају хидроксилну групу и карбонилну групу прикључену на други атом угљеника.
Системи класификације могу се комбиновати да би се описао једноставан шећер. На пример, глукоза је алдохексоза, док је рибоза кетохексоза.
Линеар вс. Цицлиц
Моносахариди могу постојати као равноланчани (ациклички) молекули или као прстенови (циклични). Кетонска или алдехидна група правих молекула може реверзибилно да реагује са хидроксилном групом на другом угљенику и формира хетероциклични прстен. У прстену атом кисеоника премошћује два атома угљеника. Прстени сачињени од пет атома називају се фуранозни шећери, док се они састоје од шест атома у облику пиранозе. У природи, равноланчани, фуранозни и пиранозни облици постоје у равнотежи. Називање молекула „глукоза“ могло би се односити на равноланчане глукозе, глукофуранозу, глукопиранозу или смешу облика.

Стереохемија
Моносахариди показују стереохемију. Сваки једноставан шећер може бити у Д- (декстро) или Л- (лево) облику. Д- и Л- облици су огледала једна другој. Природни моносахариди су у облику Д-, док су синтетички произведени моносахариди обично у облику Л.
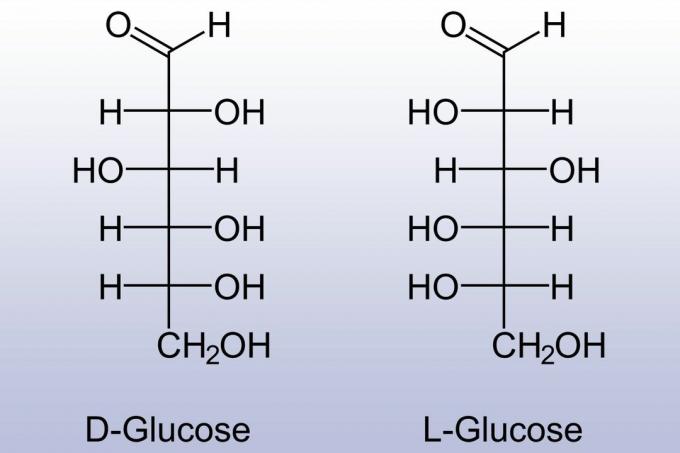
Циклични моносахариди такође показују стереохемију. -ОХ група која замењује кисеоник из карбонилне групе може бити у једном од два положаја (обично извучена изнад или испод прстена). Изомери су назначени употребом префикса α- и β-.
Извори
- Феарон, В.Ф. (1949). Увод у биохемију (2. изд.). Лондон: Хеинеманн ИСБН 9781483225395.
- ИУПАЦ (1997) Збирка хемијске терминологије (2. изд.). Саставио А. Д. МцНаугхт и А. Вилкинсон. Блацквелл Сциентифиц Публицатионс. Окфорд. дои: 10.1351 / голдбоок. М04021 ИСБН 0-9678550-9-8.
- МцМурри, Јохн. (2008). Органска хемија (7. изд.). Белмонт, Калифорнија: Тхомсон Броокс / Цоле.
- Пигман, В.; Хортон, Д. (1972). „Поглавље 1: Стереохемија моноксахарида“. У Пигман анд Хортон (ур.). Угљикохидрати: хемија и биохемија Вол 1А (2. изд.). Сан Диего: Академска штампа. ИСБН 9780323138338.
- Соломон, Е.П.; Берг, Л.Р.; Мартин, Д.В. (2004). Биологија. Ценгаге Леарнинг. ИСБН 978-0534278281.